on CROSSJECT (EPA:ALCJ)
CROSSJECT : Progrès dans la demande d'autorisation EUA pour ZEPIZURE®
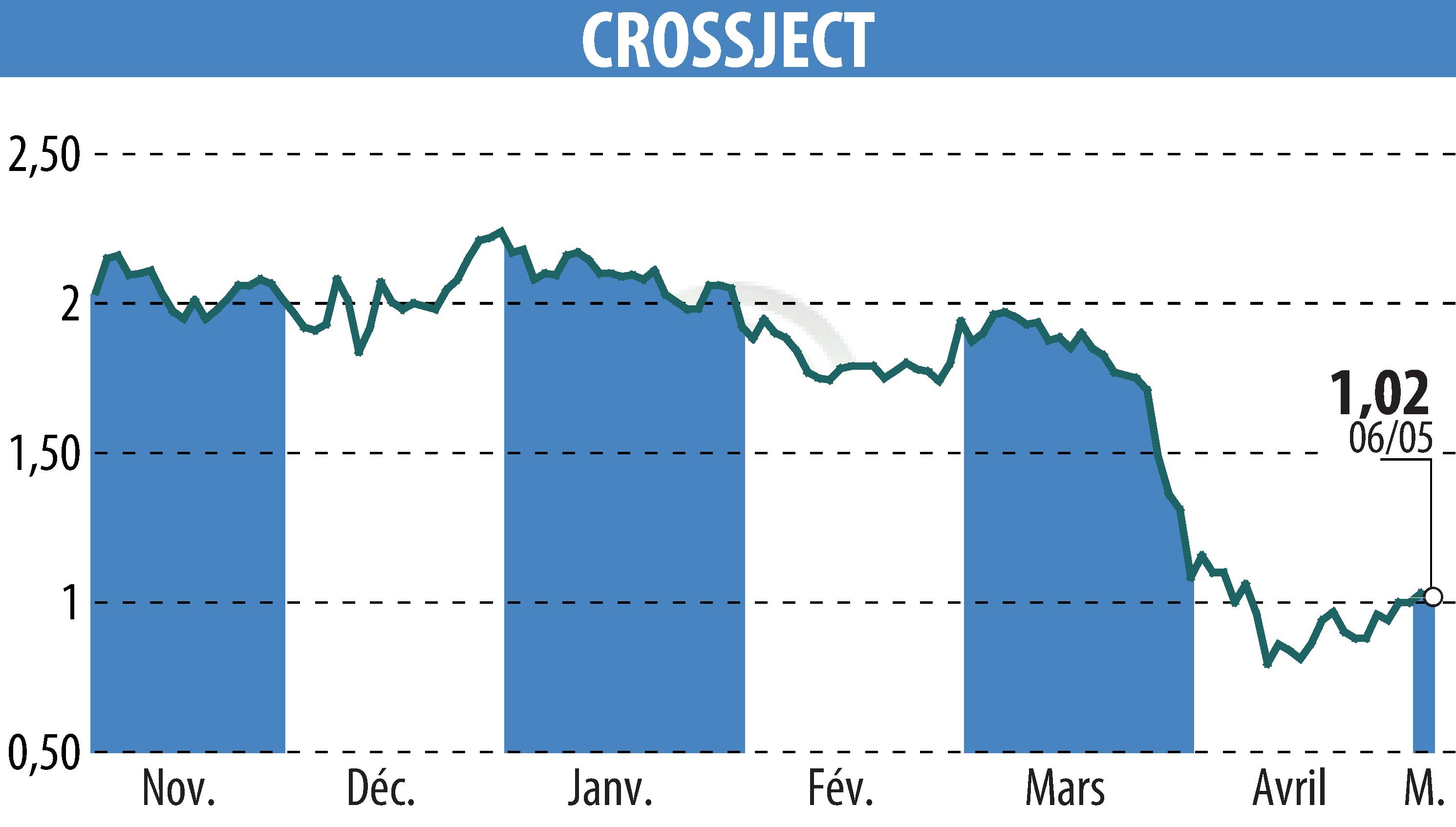
CROSSJECT a annoncé l'avancement de la demande d'autorisation d'utilisation d'urgence (EUA) de son produit ZEPIZURE® auprès de la FDA américaine. En collaboration avec EUROFINS CDMO, la société a terminé avec succès le remplissage aseptique des lots de registres requis. Ils prévoient de soumettre les dernières données de fabrication nécessaires d'ici juin 2025.
L'entreprise a initié les activités réglementaires finales pour soumettre le dossier ZEPIZURE® sous l'EUA, en coopération avec le BARDA, un partenaire aux États-Unis. Les lots pour l'EUA, destinés au programme CHEMPACK pour la préparation nationale aux menaces chimiques, ont également commencé leur production.
CROSSJECT reste optimiste quant à la réception de l'autorisation de la FDA dans le cadre de son partenariat avec BARDA, renforçant ainsi sa technologie d'injection sans aiguille ZENEO®.
R. H.
Copyright © 2025 FinanzWire, all reproduction and representation rights reserved.
Disclaimer: although drawn from the best sources, the information and analyzes disseminated by FinanzWire are provided for informational purposes only and in no way constitute an incentive to take a position on the financial markets.
Click here to consult the press release on which this article is based
See all CROSSJECT news
