on Nanohale AG (isin : DE000A1EWVY8)
Formycon et Fresenius Kabi reçoivent l'approbation de la FDA pour le biosimilaire Otulfi
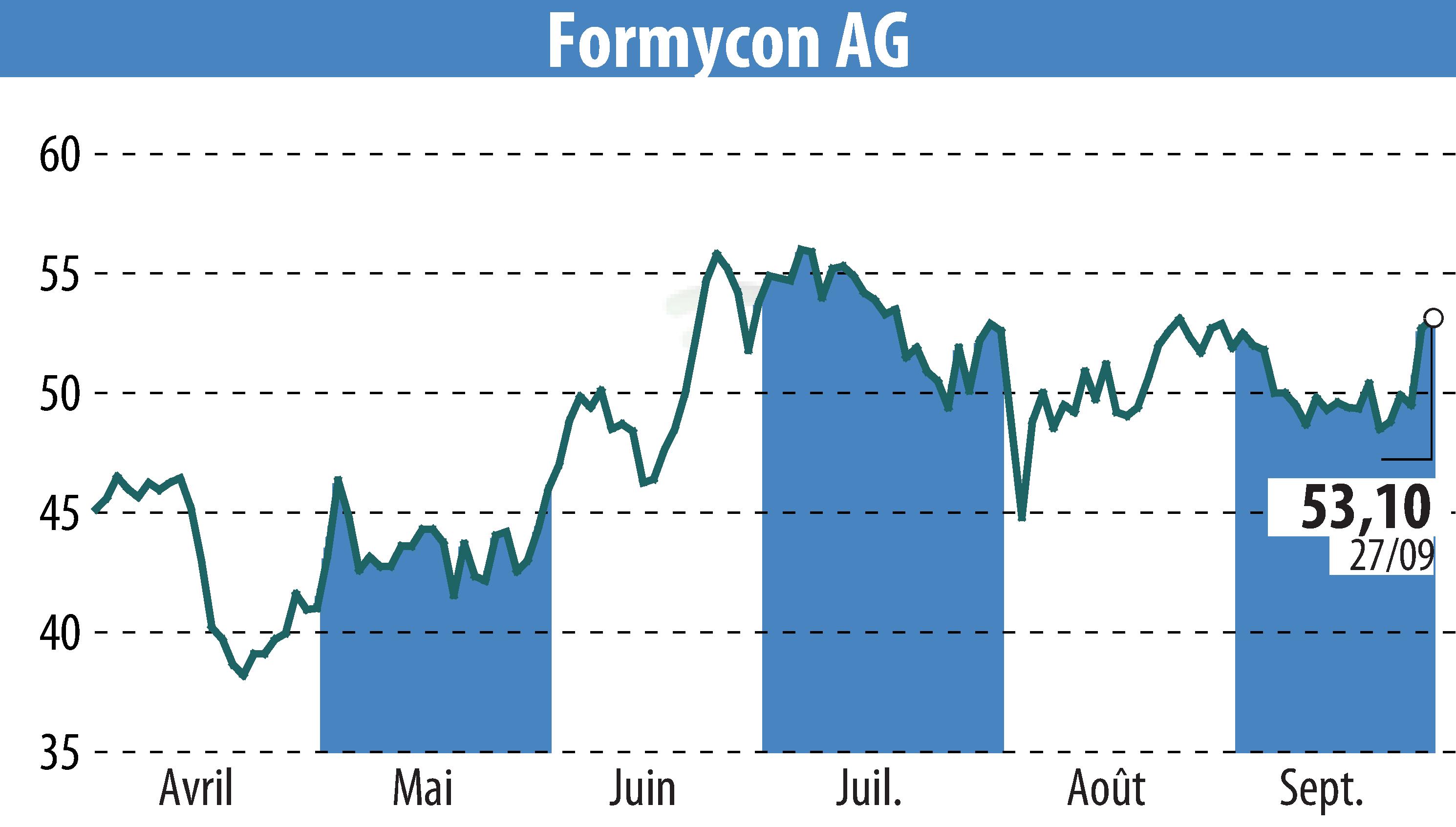
Formycon AG et Fresenius Kabi ont annoncé l'approbation par la FDA du FYB202/Otulfi (ustekinumab-aauz), un biosimilaire du Stelara, pour une utilisation sous-cutanée et intraveineuse. Il s'agit du troisième biosimilaire approuvé par la FDA pour Formycon, avec deux approbations rien qu'en 2024. Le FYB202 est approuvé pour le traitement de la maladie de Crohn, de la colite ulcéreuse, du psoriasis en plaques et de l'arthrite psoriasique.
En vertu d'un accord de brevet, Fresenius Kabi peut commercialiser Otulfi aux États-Unis d'ici le 22 février 2025. Le biosimilaire a montré une efficacité et une sécurité comparables à celles de Stelara, qui a généré plus de 10 milliards de dollars de ventes mondiales en 2023.
Le Dr Stefan Glombitza, PDG de Formycon, a souligné que cette approbation constituait une étape importante dans la continuité de ses objectifs visant à améliorer l'accessibilité aux thérapies biologiques. Le directeur financier Enno Spillner a mis l'accent sur les avantages financiers, prévoyant que l'exercice 2002 renforcera la rentabilité de Formycon.
R. P.
Copyright © 2024 FinanzWire, all reproduction and representation rights reserved.
Disclaimer: although drawn from the best sources, the information and analyzes disseminated by FinanzWire are provided for informational purposes only and in no way constitute an incentive to take a position on the financial markets.
Click here to consult the press release on which this article is based
See all Nanohale AG news
